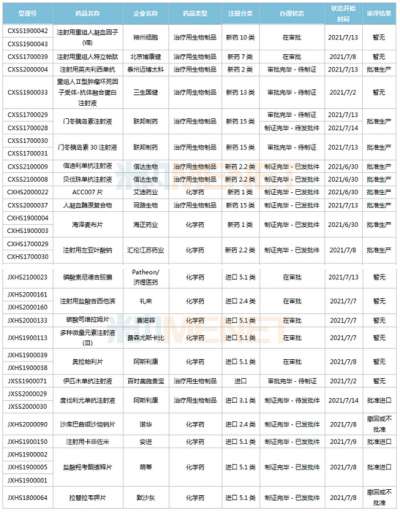
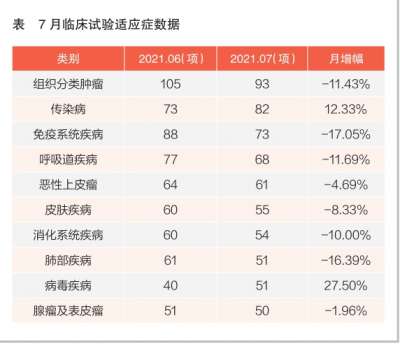
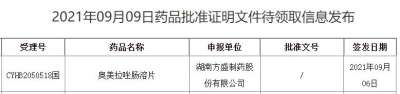
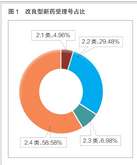
2021年诺贝尔物理学奖揭晓!盘点近10年得主及成就
据诺贝尔奖官网消息,当地时间10月5日,2021年诺贝尔物理学奖揭晓。该奖项被授予科学家真锅淑郎(Syukuro Manabe)、克劳斯·哈塞尔曼(Klaus Hasselmann)和乔治·帕里西(Giorgio Parisi),以表彰他们“对于我们对复杂物理系统的理解”,所做的开创性贡献。 在百余年的历史中,诺贝尔物理学奖囊括了诸多优秀的者。正是得益于这些科学家的不懈钻研和重磅发现,诺贝尔物理学奖才能如此“熠熠生辉”。近十年诺贝尔奖物理学奖得主的情况如下: 2020年,诺贝尔物理学奖颁发给了三位者,因为“他们发现了宇宙中最奇异的现象之一——黑洞”。英国科学家罗杰•彭罗斯因证明黑洞是爱因斯坦广义相对论的直接结果而;德国科学家赖因哈德•根策尔和美国科学家安德烈娅•盖兹因在银河系中央发现超大质量天体而。 2019年,诺贝尔物理学奖被授予两个领域的科学家,其中,加拿大裔美国科学家詹姆斯•皮布尔斯的理由是他在物理宇宙学领域的理论性发现;而瑞士科学家米歇尔•马约尔与瑞士科学家迪迪埃•奎洛兹则因“发现了围绕其他类太阳恒星运行的系外行星”。 2018年,诺贝尔物理学奖被授予美国科学家阿瑟•阿什金、法国科学家热拉尔•穆鲁及加拿大科学家唐娜•斯特里克兰,以表彰其在激光物理学领域取得的突破性贡献。 2016年,英国科学家大卫•索利斯、邓肯•霍尔丹和迈克尔•科斯特利茨,因在理论上发现了物质的拓扑相变和拓扑相而荣获该奖项。 2015年,日本科学家梶田隆章和加拿大科学家亚瑟•麦克唐纳共同获诺贝尔物理学奖。两人因发现中微子振荡,证明中微子有质量而。 2014年,诺贝尔物理学奖得主是日本科学家赤崎勇、日裔美国科学家中村修二及日本科学家天野