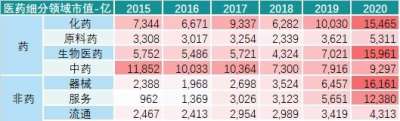
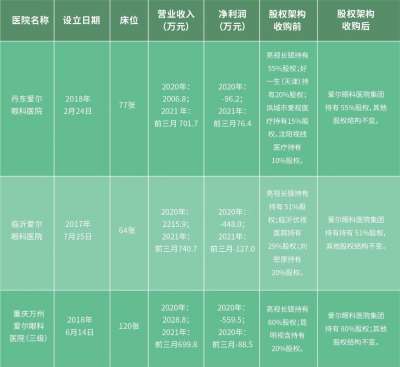
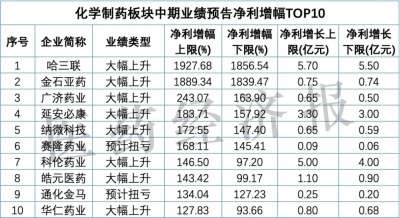
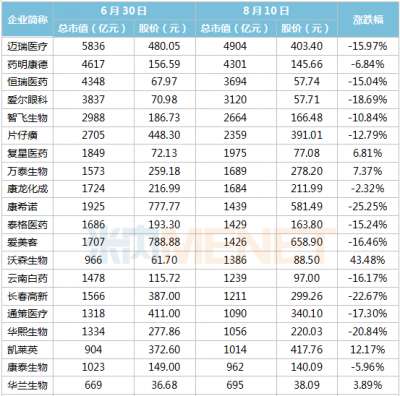
「替雷利珠单抗」美国上市申请获 FDA 受理
9 月 13 日,百济神州宣布,美国食品药品监督管理局(FDA)已受理其抗 PD-1 抗体药物百泽安®(替雷利珠单抗注射液)的新药上市申请(BLA),用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。根据《处方药使用者付费法案》(PDUFA),FDA 对百泽安®上市申请做出决议的目标日期为 2022 年 7 月 12 日。 此次上市申请为百济与诺华联合申报,基于一项随机、开放性、多中心的全球 3 期临床试验 RATIONALE 302(NCT03430843)的研究结果,该试验旨在评估百泽安®对比研究者选择的化疗,用于晚期或转移性 ESCC 患者二线治疗的有效性和安全性。该项试验结果已在 ASCO 2021 上公布。此外,此次申报还基于包括 7 项临床试验中接受百泽安®单药治疗的 1972 例患者的安全性数据。 除美国外,百泽安®用于治疗既往接受过一线化疗后进展或不可耐受的局部晚期或转移性 ESCC 患者的适应症上市申请已在中国获受理,当前正在审评过程中。 食管癌是消化道领域最常见的恶性之一,主要分为鳞癌和腺癌。目前美国 NCCN 和国内 CSCO 指南均推荐免疫方案治疗食管鳞癌,食管鳞癌已经正式进入了免疫治疗时代。 RATIONALE 302 研究是一项随机、开放性、多中心的全球 3 期临床试验(NCT03430843),旨在评估百泽安®对比研究者选择的化疗作为晚期或转移性 ESCC 患者二线治疗的有效性和安全性。试验主要终点是意向性治疗(ITT)人群的总生存期(OS);关键次要终点是 PD-L1 高表达患者(定义为目测估计综合阳性评分 [vCPS] ≥10%)的 OS,其他次要终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DoR)和安全性。 试验共入组 512 例患者,来自亚洲、欧洲和北美的 11 个国家或地区,1:1 随机分配于替雷利珠单抗组或化疗