加快新药上市的临床研究及申报策略
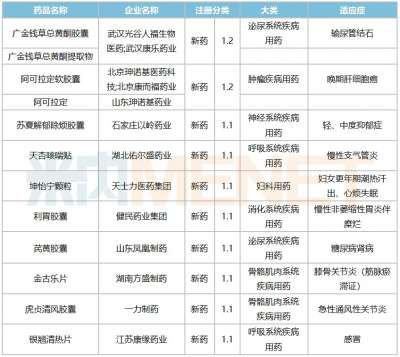
医药网8月11日讯 在国家新药创新政策鼓励下,越来越多的制药企业参与新药研发,创新药获批数量增长显著。提高新药临床试验成功率,加快新药上市速度,做好新药临床研究一体化顶层设计、运营管控及申报上市等尤为重要。 临床研究一体化顶层设计 根据药物研发全流程关键节点,新药临床研究一体化顶层设计需要从以下几方面考虑: 一是临床研究前整体规划,该环节很大程度上决定了临床研究策略;二是各环节的衔接,包括临床前研究与临床研究的衔接、临床各期试验之间的衔接;三是各个学科和专业间的协调沟通;四是管理制度的稳健和规范性;五是团队人员的高效执行力等。 临床研究运营管控 临床研究运营管控是保证顶层设计落地的手段。 临床试验从开题、合作方筛选、审查、启动入组至最后提交注册申报资料,共分为19个一级环节,67个二级环节,134个三级执行环节。要实现优质高效管理,需要制定详细的项目计划,并按照流程划分不同计划等级。 临床研究运营管控的三要素为进度、成本和质量,进度指的是临床试验从开始到最终获批完成的进展;成本指的是投入的费用和资源;质量指的是完成的结果符合科学、、规范和申报要求的程度。三者既相互独立又紧密联系,需要做好平衡,并根据不同阶段进行调整。 进度管控 开展临床试验的前提是完成遗传办申报、拿到遗传办批件。当前,遗传办申报工作主要依据的是《人类遗传资源管理条例》。国内创新药临床试验通常会涉及“采集审批”“国际合作审批/备案”“信息对外提供或开放使用备案”,关注的内容分别表现在临床试验人数是否超过500、合作方是否涉及外资、临床试验产生信息是否出境等。从项目立项、方案设计到临床试验具体实施,整个流程都应考虑遗传资源方面的内容。 成本管控 常规成本管控一般经历资源分配计划、费用初步估算、成本预算、成本控制等环节。成本控制的关键是做好成本预算,提前了解资源、规划资源和实现最佳分配资源。 质量管控 质量管控的目标是保护受试者权益,要遵循和法律法规要求,获得真实、规范、完整的临床试验数据。应建立相应的制度和体系,并对相应制度、体系、试验相关内容进行培训。此外,还应做好风险管理,包括风险的识别、预防及纠正,并制定快速反应和处理机制。 申报上市 我国注册政策和申报通道的持续完善,体现了对新药研发的支持和鼓励。目前,在加快新药申报上市方面,主要有以下支持制度: 一是会议制度,包括Ⅰ、Ⅱ、Ⅲ类会议。Ⅰ类会议是指药物临床试验过程中遇到重大安全性问题,以及突破性治疗药物研发过程中遇到重大技术问题时召开的会议。Ⅱ类会议是指在药物研发关键阶段召开的会议,主要包括新药临床试验申请前会议;新药Ⅱ期临床试验结束/Ⅲ期临床试验启动前会议;新药上市申请前会议;风险评估和控制会议等。Ⅲ类会议是除Ⅰ类和Ⅱ类会议之外的其他会议。二是4个程序,包括突破性治疗药物程序、附条件批准程序、优先审评审批程序及特别审批程序。(新领先药讯供稿)
标签:新药上市
相关资讯
-
汇宇首个新药来了 抢食60亿心血管大品种
医药网8月23日讯 8月18日,四川汇宇制药提交了丁苯酞注射液2.2类新药临床申请,并获得了CDE承办。目前国内市场上的丁苯酞相关产品仅有石药的丁苯酞氯
标签: 汇宇 -
零售卖超10亿的消化性溃疡药 这家湖南药企过评
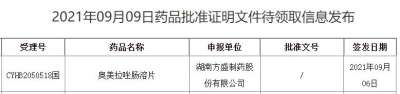
9月9日,NMPA官网发布最新一批药品获批信息,湖南方盛制药的奥美拉唑肠溶片获批通过一致性评价。奥美拉唑是治疗消化性溃疡药的TOP1品种,受疫情和集采
标签: 消化性溃疡药
-
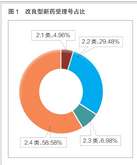
医药网8月20日讯 在开发新靶点越来越难、仿制药竞争越来越激烈的情况下,对于无法承担原始创新巨大成本的仿制药企业来说,改良型新药正在成为一种
-
医药网8月23日讯 8月18日,四川汇宇制药提交了丁苯酞注射液2.2类新药临床申请,并获得了CDE承办。目前国内市场上的丁苯酞相关产品仅有石药的丁苯酞氯
-
医药网8月27日讯 近日,常州四药以仿制3类报产的缬沙坦口服溶液进入行政审批阶段,有望成为国内首个缬沙坦口服溶液产品。缬沙坦为临床常用的降压药
-
9月9日,NMPA官网发布最新一批药品获批信息,湖南方盛制药的奥美拉唑肠溶片获批通过一致性评价。奥美拉唑是治疗消化性溃疡药的TOP1品种,受疫情和集采