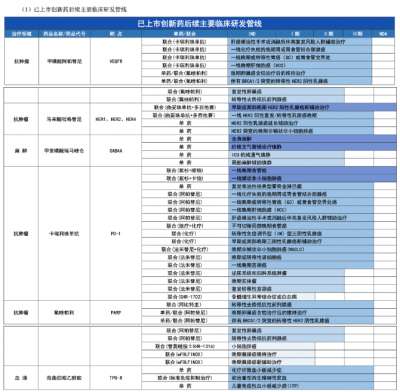
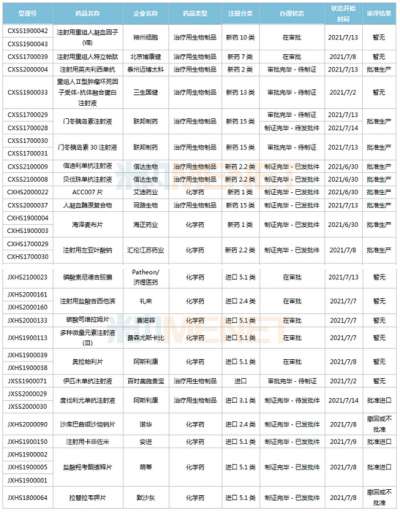
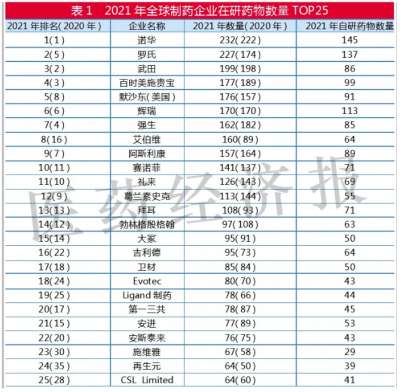
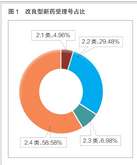
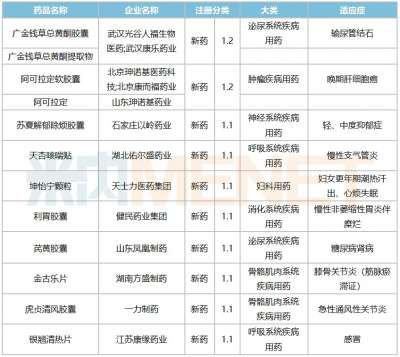
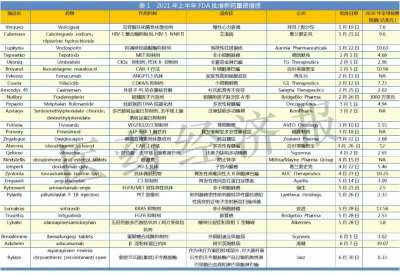
恒瑞半年报国内外研发管线霸屏!转型压力正在释放?
医药网8月20日讯 8月19日晚间,恒瑞医药发布2021年半年报,报告显示,今年上半年恒瑞医药研发投入超过25.8亿元,同比增长38.48%,研发投入占销售收入比重达到19.41%,创历史新高。 同时,在本次财务报告中,恒瑞医药全面披露了其最新的产品管线,涵盖已上市创新药后续主要临床研发管线、在研创新药主要临床研发管线、海外创新药主要临床研发管线,“国内外共开展240多个临床项目”等信息,引发业内关注。 今年上半年,恒瑞医药正式迈入业务板块从仿制药向创新药迁移的关键过渡期。在经历了带量采购仿制药销售下滑、创新药医保谈判放量考验之后,孙飘扬“二次出山”执掌帅印,业界十分关注恒瑞医药下一步的发展走向,半年报内容所展示的产品管线与研发投入,已经让市场感受到了恒瑞医药新阶段的创新与国际化决心。 恒瑞的“抽屉”正在打开 “无论是小分子,还是大分子,恒瑞的创新药在研发数量和临床推进速度上都遥遥领先,更关键的是,你猜不到孙飘扬和恒瑞的‘抽屉’里还藏着多少新药!”2020年年底,恒瑞医药市值突破6000亿元,在一次医药创新研发会议上,一位嘉宾发出了这样的感慨。 每每论及本土医药转型升级和研发创新,恒瑞医药都是绝对不能忽视的存在。然而,进入2021年,面对带量采购竞争压力,本土医药创新“临床价值”大讨论,恒瑞股价震荡走低,短短半年市值蒸发逾2000亿元。 如今,全行业都在经受医药产业生态变革的考验,适应新常态之下的全新市场法则。面对带量采购常态化带来的激烈竞争,医保支付制度改革和价格谈判之后放量压力,众多都面临着与恒瑞医药相同的市场压力。 正如恒瑞医药在本次半年报中所描述的,自2018年以来,公司进入国家集中带